Як підвищити кваліфікацію
у центрі прогресивної освіти "Генезум"?

-
 збірник матеріалів
збірник матеріалів
-
 публікація на сайті genezum.org безкоштовна
публікація на сайті genezum.org безкоштовна
-
 заочна участь
заочна участь
-
 для закладів загальної середньої освіти
для закладів загальної середньої освіти
-
 для закладів дошкільної освіти
для закладів дошкільної освіти
-
 Сертифікат - 5 год, 0.05/0.1 ЄКТС
Сертифікат - 5 год, 0.05/0.1 ЄКТС

-
 постійний доступ
постійний доступ
-
 можна проходити у будь-який час
можна проходити у будь-який час
-
 дистанційне навчання
дистанційне навчання
-
 для закладів загальної середньої освіти
для закладів загальної середньої освіти
-
 для закладів дошкільної освіти
для закладів дошкільної освіти
-
 Сертифікат - 16/30 год, 0.5/1 ЄКТС
Сертифікат - 16/30 год, 0.5/1 ЄКТС

-
 безкоштовний перегляд
безкоштовний перегляд
-
 інтерактив зі спікером
інтерактив зі спікером
-
 онлайн формат
онлайн формат
-
 для закладів загальної середньої освіти
для закладів загальної середньої освіти
-
 для закладів дошкільної освіти
для закладів дошкільної освіти
-
 Сертифікат - 2 год, 0.06 ЄКТС
Сертифікат - 2 год, 0.06 ЄКТС

Мета: сформувати поняття про йонний зв’язок, розглянути механізм його утворення, сформувати навички відрізняти сполуки з ковалентним та йонним зв’язком.
Обладнання: періодична система хімічних елементів Д. І. Менделєєва, таблиця електронегативностей хімічних елементів.
Базові поняття та терміни: хімічний зв’язок, іонний зв’язок, полярний та не‑полярний ковалентний зв’язок, спільна електронна пара, електронегативність.
Тип уроку: комбінований.
Методи навчання: пояснювально ‑ілюстративні — бесіда, розповідь; практичні — розв’язування вправ.
Структура уроку
- Організаційний етап ................................. 1 хв.
- Актуалізація опорних знань ........................... 10 хв.
- Вивчення нового матеріалу ............................16 хв.
- Закріплення та систематизація знань ...................15 хв.
- Домашнє завдання ................................... 1 хв.
- Підбиття підсумків уроку ............................. 2 хв.
Хід уроку
І. Організаційний етап
Перевірка готовності учнів до уроку, налаштування на робочий настрій.
ІІ. Перевірка домашнього завдання
1) Які типи хімічного зв’язку ви знаєте?
2) Що називається ковалентним зв’язком?
3) Який ковалентний зв’язок називають неполярним? Полярним?
Наведіть приклади.
4) Від чого залежить тип хімічного зв’язку?
5) Які елементи утворюють ковалентний полярний зв’язок?
6) Які елементи — металічні чи неметалічні — мають більш високу електронегативність?
7) Які елементи здатні віддавати електрони із зовнішнього енергетич -ного рівня для отримання конфігурації інертного газу?
Учитель повідомляє, що на уроці буде розглянуто випадок, коли елементи, що входять до складу речовин, значно відрізняються по електронегативності, і називає тему уроку, учні формулюють питання, які слід розглянути на уроці.
ІII. Вивчення нового матеріалу
- Утворення йонного зв’язку.
Розповідь учителя
Ви вже розумієте, як взаємодіють між собою неметали: між їх атомами встановлюється ковалентний зв'язок. А тепер розглянемо, як взаємодіють неметали з металами. Атоми цих елементів дуже відрізняються за своєю електронегативністю, тому спільна електронна пара, яка утворює зв'язок, настільки змішується до атома з більшою електронегативністю, що практично належить тільки цьому атому. Наприклад, натрій взаємодіє з хлором:
2Na + Сl2 = 2NaCl
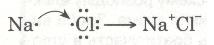
Зовнішній енергетичний рівень атома Натрію (як і будь-якого лужного металу) далекий від завершення — містить один електрон, який слабко зв'язаний з ядром, бо великий радіус атома. Тому під час хімічних перетворень атоми Натрію легко втрачають єдиний валентний електрон і перетворюються з нейтральних атомів на позитивно заряджені йони:
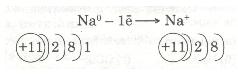
Передостанній енергетичний рівень з восьми електронів стає останнім, зовнішнім, і атом Натрію набуває стійкого енергетичного рівня, подібно до атома Неону Ne.
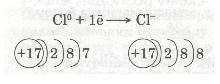
Зовнішній енергетичний рівень атома Хлору має сім валентних електронів. Він близький до завершення. Радіус атома Хлору невеликий, а електронегативність дуже велика. Тому атом Хлору приймає один електрон від атома Натрію, добудовуючи зовнішній рівень до октету (вось-миелектронної структури). У цьому разі атом Хлору набуває негативного заряду -1, перетворюючись на негативно заряджений йон:
Отже, валентний електрон атома Натрію під час взаємодії з атомом Хлору повністю переходить на зовнішній рівень атома Хлору. Схематично цей процес можна передати так:
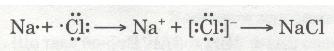
Йони — це електрично заряджені частинки речовини, що утворилися з атомів або атомних груп унаслідок втрати або приєднання електронів.
Різнойменно заряджені йони Натрію Na+ і Хлору Сl-, притягуючись один до одного завдяки наявності сили притягання, утворюють сполуку — натрій хлорид NaCl. Цей процес можна записати ще й у такий спосіб:
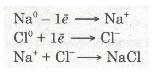
Хімічний зв'язок, утворений за допомогою взаємодії йонів, називають йонним зв'язком.
Речовини, що складаються з йонів, називаються йонними сполуками. Вони утворені типовими металами і типовими неметалами. Атоми металів віддають електрони, а атоми неметалів їх приймають.
Приклади речовин з йонним типом хімічного зв 'язку:
NaCl, NaBr, NaF, MgCl2, MgS, NaOH, Li2O, Ca3P2, AlCl3, BaO, KCl
Розпишіть механізм утворення.
Зверни увагу, заряд йонів позначають зверху, праворуч від хімічного знака: спочатку — цифру, а потім — знак «+» aбо «-».
Йонний зв'язок є крайнім випадком полярного ковалентного зв'язку. Йонні сполуки в твердому стані — кристалічні речовини. У йонних кристалах електростатичне поле кожного йона поширюється у всіх напрямках, тому ионний зв'язок не має напрямленості.
- Закріплення та систематизація знань
Bисновки: йонний зв'язок обумовлений взаємодією між різнойменно зарядженими йонами. Сполуки з йонним типом хімічного зв'язку виникають у тому разі, коли взаємодіють атоми елементів з дуже відмінною електронегативністю — атоми типового металу і типового неметалу, тобто елементи, розміщені на початку і в кінці періодів періодичної системи. Найтиповіший йонний зв'язок виникає в солях, утворених лужними металами і галогенами.
Йонний зв'язок і неполярний ковалентний зв'язок — два крайні випадки розподілу електронної густини. Неполярному зв'язку відповідає рівномірний розподіл спільної двохелектронної хмари між однаковими атомами. Якщо зв'язок йонний, навпаки, спільна електронна пара практично повністю належить одному з атомів, у якого електронегативність більша.
Завдання для самоконтролю
- Що таке йонний зв'язок? Між якими елементами він виникає?
- Чим відрізняється йонний зв'язок від ковалентного полярного і неполярного? Відповідь поясни.
- Напиши схеми утворення йонного зв'язку: а) у калій броміді КВr; б) у натрій сульфіді Na2S; в) у кальцій нітриді Ca3N2.
- Серед наведених формул речовин зазнач сполуки з йонним, полярним і неполярним ковалентними зв'язками і поясни їх будову: НІ, Н20, РН3, CaS, ZnCI2, SiH4, ССl4.
- Запиши формули сполук, до складу яких входять такі йони: a) Na+і Вr-; б) Са2+і Сl-; в) К+ і S2+. Назви ці сполуки.
- Яскраво виражений йонний зв'язок у парі атомів
(а) K—F; (в) F—F;
(б) 0—F; (г) P—F.
- Хлор у сполуках утворює йонні зв'язки з
(а) К; (б) Н; (в) Са; (г) С.
Додаткові завдання
- Пара елементів, атоми яких під час хімічної взаємодії виявляють максимальну тенденцію до утворення сполуки з йонним зв'язком, — це
(а) Cu i F; (в) Na і F;
(б) C i N; (г) Li i Н.
- Між атомами елементів з протонними числами 3 і 9 виникає зв'язок (а) ковалентний полярний; (б) ковалентний неполярний; (в) ионний.
10*. У натрій гідроксиді йонними є зв'язки
(а) між Натрієм і Оксигеном;
(б) між Гідрогеном і Оксигеном;
(в) між Натрієм і Гідрогеном;
(г) усі зв'язки.
11*. Порівняй будову йонів Мg2+ і F- з будовою атома Неону. Знайди подібні й відмінні ознаки.
12*. На що перетворився б атом Аргону, якби з його ядра зник один протон, а електронна оболонка залишилася без змін?
13*. В якої з двох речовин: (a) LiH; (б) CsH ионний тип хімічного зв'язку між атомами виражений сильніше? Чому?
- Домашнє завдання: вивчити матеріал підручнику та виконати завдання
- Підбиття підсумків уроку
Учитель просить учнів визначити результати уроку. Чи отримані відповіді на питання, що ставилися на початку уроку?
